1. 方法驗證
分析方法驗證是證明分析程序適合其預期目的的過程5。并非所有驗證特征都適用于粒度分析。較早的 FDA 工業(yè)指南(非實施)草案文7包括一個專門針對粒度分析的部分。盡管較新的已發(fā)布文件取代了較舊的指南草案,但有關粒度分析的較舊部分提供了有關粒度分析與其他技術(如 HPLC)的不同之處的見解。舊文檔中的以下聲明有助于方法驗證工作:
“方法驗證通常涉及中間精度和重復性的評估。應保證生成的數(shù)據(jù)是可重復的,并控制產(chǎn)品的質(zhì)量。"7
考慮到這一評論,下面提供了解決 DLS 方法驗證的建議:
● 特異性:N/A,DLS 檢測大小變化但對不同化學物質(zhì)不敏感。
● 線性:N/A,DLS 沒有任何線性關系。
● 準確性:N/A,儀器的準確性使用標準粒子進行驗證,但常規(guī)定量裁判方法(SEM/TEM 顯微鏡)不包括準確性確定。包括樣品的 SEM/TEM 圖像以支持方法驗證可能是更合適的。
● 精密度(重復性、中間精密度和重現(xiàn)性):這是需要重點關注的地方。通常這些術語的定義在粒度分析領域可能不同于其他技術。以下評論來自粒度分析領域:
重復性:多次測量樣品。
重現(xiàn)性:準備樣品、測量、丟棄、清潔、重復。建議的方法是制備五份樣品,然后對每個樣品進行五次分析。
中間精密度:此活動涉及第二位分析員、第二臺儀器或兩者兼而有之。如果所有測試都在一個地點進行,則由同一系統(tǒng)上的不同操作員在不同日期分析同一批次的樣品。如果要在多個地點進行測試,則同一樣本(或批次)由不同操作員在不同地點的不同系統(tǒng)上進行分析。
● 范圍:N/A,僅在所用系統(tǒng)的工作范圍內(nèi)工作。無需對此進行測試或記錄。
● 定量限:N/A,這只是測試粒徑。
● 檢測限:N/A,方法開發(fā)應確保樣品在系統(tǒng)檢測限內(nèi)。
2. 結構示例
兩名操作員在兩個 Nicomp DLS 系統(tǒng)上分析了一種藥物物質(zhì)(異丙酚乳劑)。該樣品已過期,但仍顯示符合 USP<729>的合格結果。儀器設置如下:
Instrument A:
| Instrument type | Nicomp 3000 |
| Age | 5 years old |
| Laser power | 35 mW |
| Detector | PMT |
| Detector angle | 90° |
| Software version | ZPW388 V2.17.0215 |
Instrument B:
| Instrument type | Nicomp 3000 |
| Age | new |
| Laser power | 35 mW |
| Detector | PMT |
| Detector angle | 90° |
| Software version | ZPW388 V2.17.0215 |
3. 方法開發(fā)
首先分析 92 nm PSL 標準以確保適當?shù)南到y(tǒng)性能。測量結果在預期值的 98% 以內(nèi)。建議在開始此類工作之前進行此驗證測試。
接下來進行快速研究以測試濃度(稀釋)的影響。參見圖 1 中的結果。
遵循這些指南的內(nèi)容,DLS 規(guī)格(根據(jù)定義尺寸小于 10 µm)對于強度平均值可以是可重復的 ±20%,對于 PI 或其他計算結果指示分布寬度是可重復的 ±30%。對于某些藥品,這可能是一個可以接受的范圍,但要注意當粒徑非常小時出現(xiàn)的統(tǒng)計問題。如果平均粒徑為 500 nm,±20%,則范圍為 400 – 600 nm,這還不錯。但對于平均粒徑為 10 nm 的蛋白質(zhì),范圍則為 8-12 nm,這樣的粒徑跨度變得非常挑戰(zhàn)且難以接受。
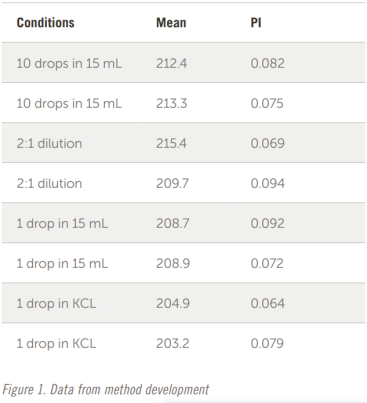
將 10 滴樣品加入 15 mL 去離子水中并進行分析。重復相同的制備。然后將這些樣品按 2:1 稀釋并進行分析。樣品看起來太渾濁,結果發(fā)生變化,因此將下一滴添加到 15 mL DI 水中。樣品出現(xiàn)輕微混濁,這些結果是可以接受的。有時,稀鹽溶液是比純?nèi)ルx子水更好的稀釋劑。下一步是將一滴樣品加入 10 mL 過濾后的 10 mM KCl 溶液中。這些結果似乎更好,因此 10 mM KCl 溶液用于本研究中的所有其他測量。
在進行稀釋研究時,分析時間也從3分鐘到10分鐘不等。三分鐘、五分鐘和十分鐘分析時間的時間曲線圖如圖2-4所示。紅色=光強粒徑平均值,藍色=體積粒徑平均值,藍色=數(shù)量粒徑平均值。
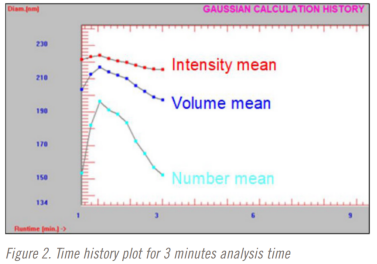
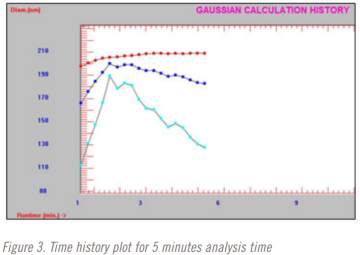
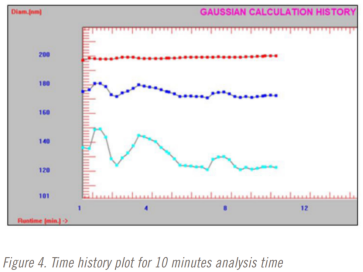
該方法選擇了5分鐘的分析時間。在五分鐘的分析時間完成之前,光強平均粒徑結果已經(jīng)穩(wěn)定下來。但直到大約9分鐘前,體積和數(shù)量加權平均結果仍在變化。這是也是在使用DLS時僅選擇光強粒徑結果的一個原因。這可能是方法開發(fā)中測試重復性很好的一個點。在這種情況下,也許下一個測試的分析時間是四分半、五分和五分半鐘。在這項研究中沒有執(zhí)行這一步驟,值得指出的是,整個方法開發(fā)和驗證研究在不到8個小時內(nèi)完成。更嚴格的最終發(fā)布測試方法開發(fā)和驗證方法很可能需要至少幾天時間。
4. 樣品準備
——在干凈的瓶子里裝滿10毫升過濾后的KCl溶液
——用針頭注射器取出0.5毫升異丙酚
——在瓶子里注入1滴異丙酚和10毫升KCl溶液
——手旋轉直到混合(10秒)
——用一次性移液管將400μL樣品移入圓形一次性玻璃樣品池
——將玻璃樣品池放入黑色Holder支架·在Nicomp上打開樣品蓋
——將樣品池和支架插入Nicomp系統(tǒng),Holder支架背向Nicomp的左側
——關閉Nicomp上的樣品蓋
確保儀器設置與如下所示的值匹配:
| Temp | 23℃ |
| Viscosity | 0.933 cP |
| Liquid index of refraction | 1.333 |
| Intensity setpoint | 300 KHz |
| First channel usd | 2 |
| External fiber angle | 90° |
| Scattering angle | 90° |
| Print molecular weight | unchecked |
| Autoset channel width | checked |
| Autoset sensitivity | checked |
| Auto nicomp parameter | checked |
| Auto baseline adjust | checked |
| Cum % set point | 10% |
| Autodilution ND position | N/A |
| Number of print/save cycles | 5 |
| Using run time | 5 minutes |
| Using fit error | unchecked |
| Clear autocorrelator | unchecked |
| Print result | unchecked |
| Automatic choice of distribution | unchecked |
| Store data on disk | checked |
| Overwrite old file | unchecked |
| Save data log | checked |
——單擊綠色“G"圖標開始測量
——打印并記錄平均直徑、標準偏差、PI 、D10、D50 和 D90
——將結果輸入 Excel 電子表格
——計算五項分析的平均值和變異系數(shù)
——比較兩個數(shù)據(jù)集
5. 結果
樣品在 A 和 B 系統(tǒng)上獨立制備和分析。每個樣品分析五次以檢查重復性。這兩個系統(tǒng)的示例結果如圖 5 和圖 6 所示。
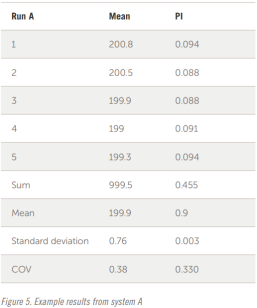
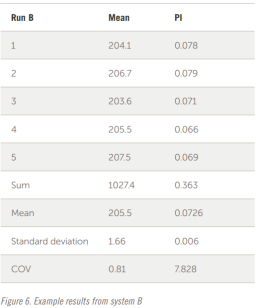
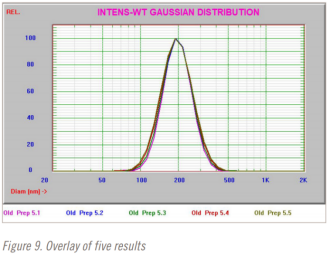
整個結果以表格形式顯示在圖 7 和圖 8 中。五個結果的疊加如圖所示。
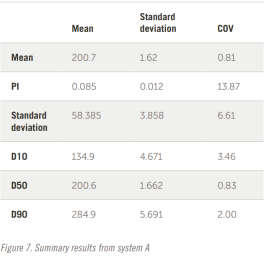
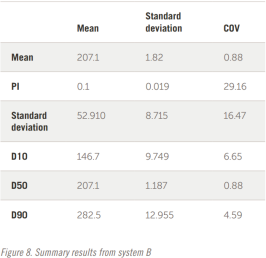
6. 結論
查看綜合結果可以得出以下幾點觀察結果:
——即使是相隔數(shù)年生產(chǎn)的兩個系統(tǒng)也會生成相似的數(shù)據(jù)
——兩個系統(tǒng)之間存在明顯的 3% 偏差
——PI計算可能不是用于定義寬度分布的最佳值
——如果使用PI,則30%的差值似乎是合適的
——D10、D50、D90 結果顯示出更好的重現(xiàn)性,可能更容易為制藥行業(yè)所接受
純粹基于該數(shù)據(jù)集,基于三個測量的該藥物產(chǎn)品的規(guī)格可能類似于:
——光強平均值 = 200 nm ±20%,COV = 小于 20%
——D10 = 140 nm ±30%,COV = 小于30%
——D90 = 284 nm ±30%,COV = 小于 30% 或
——PI = 0.09 ±30%
上述建議規(guī)格僅來自觀察到的重現(xiàn)性,可能對藥物安全性或有效性沒有任何影響。USP<729>中的實際是否通過標準的要求只是粒徑尺寸必須低于 500 nm 并且具有低x2值。質(zhì)量標準的另一種方法可能是關注影響有效性和/或安全性的粒徑大小。本技術說明收集的數(shù)據(jù)是讓您了解 DLS 技術對于簡單樣品的可重復性/重現(xiàn)性
7. 儀器介紹
參考資料
1 USP<729>, Globule Size Distribution in Lipid Injectable Emulsions
2 ISO 22412 Particle size analysis — Dynamic light scattering (DLS)
3 USP<429>, Light Diffraction Measurement of Particle Size
4 Entegris Technical Note, DLS Sample Preparation
5 Analytical Procedures and Methods Validation for Drugs and Biologics, July 2015
6 Entegris Technical Note, DLS System Verification
7 Guidance for Industry, Analytical Procedures and Methods Validation, Draft Guidance, July 2000. No longer available for download at FDA website.
8 Entegris Technical Note, DLS Data Interpretation